
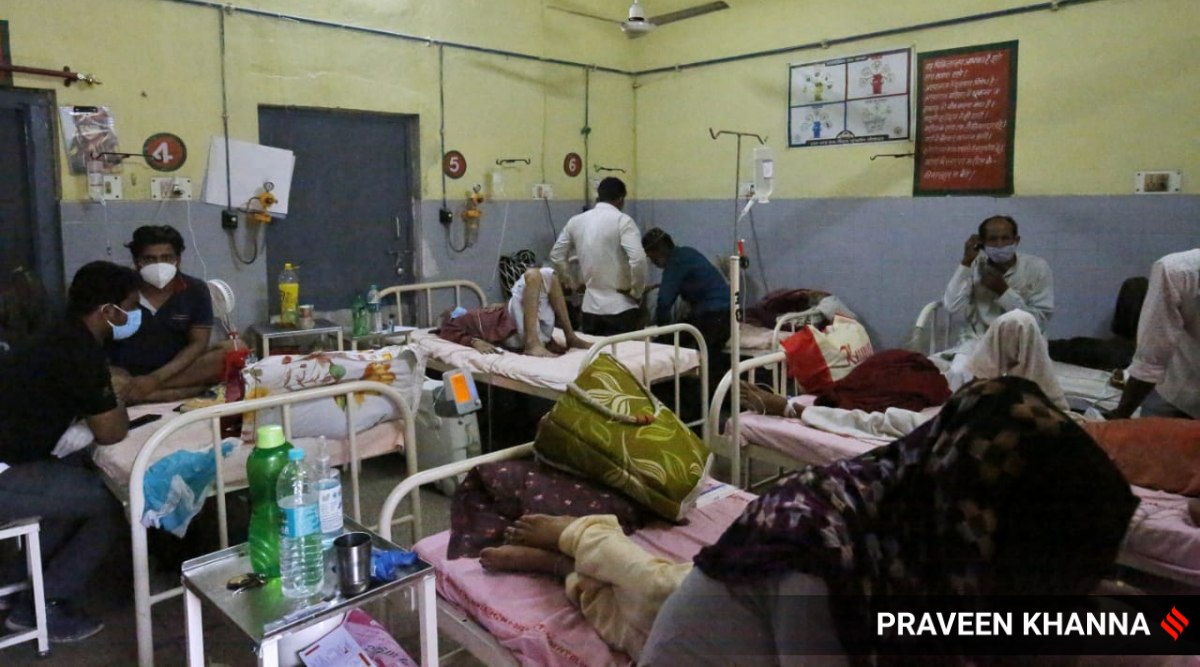
 Membri della famiglia che si prendono cura dei pazienti Covid all'interno del reparto di isolamento Covid dell'ospedale distrettuale di Muzaffarnagar nell'Uttar Pradesh.
Membri della famiglia che si prendono cura dei pazienti Covid all'interno del reparto di isolamento Covid dell'ospedale distrettuale di Muzaffarnagar nell'Uttar Pradesh.
Un farmaco orale anti-COVID sviluppato dal DRDO è stato approvato dal Drugs Controller General of India (DCGI) per l'uso di emergenza come terapia aggiuntiva nei pazienti con coronavirus da moderato a grave, ha detto sabato il ministero della Difesa.
Gli studi clinici del farmaco 2-deossi-D-glucosio (2-DG) hanno dimostrato che aiuta a un recupero più rapido dei pazienti ospedalizzati e riduce la dipendenza dall'ossigeno supplementare, ha affermato.
L'approvazione del farmaco è arrivata in un momento in cui l'India è alle prese con un'ondata record di pandemia di coronavirus che ha portato al limite le infrastrutture sanitarie del paese.
https://images.indianexpress.com/2020/08/1×1.png
& # 8220; Nella seconda ondata COVID-19 in corso, un gran numero di pazienti si trova ad affrontare una grave dipendenza dall'ossigeno e necessita di ricovero.
Notizie principali in questo momento
Fare clic qui per ulteriori informazioni
& # 8220; Si prevede che il farmaco salverà vite preziose a causa del meccanismo di funzionamento del farmaco nelle cellule infette. Ciò riduce anche la degenza ospedaliera dei pazienti COVID-19, & # 8221; ha detto il ministero.
Ha affermato che l'applicazione terapeutica anti-COVID-19 del farmaco 2-DG è stata sviluppata dall'Institute of Nuclear Medicine and Allied Sciences (INMAS), un laboratorio leader della Defense Research and Development Organization (DRDO), in collaborazione con il Dr Reddy & # 8217; s Laboratories (DRL) a Hyderabad.
& # 8220; Il 1 ° maggio, DCGI ha concesso il permesso per l'uso di emergenza di questo farmaco come terapia aggiuntiva in pazienti COVID-19 da moderati a gravi. Essendo una molecola generica e un analogo del glucosio, può essere facilmente prodotto e reso disponibile in abbondanza nel paese, & # 8221; ha dichiarato il ministero in una dichiarazione.
La terapia aggiuntiva è un trattamento utilizzato insieme al trattamento primario per assisterla.
Il farmaco si presenta sotto forma di polvere in una bustina e viene assunto per via orale da sciogliendolo in acqua.
& # 8220; Si accumula nelle cellule infettate da virus e previene la crescita del virus bloccando la sintesi virale e la produzione di energia. Il suo accumulo selettivo nelle cellule infettate viralmente rende questo farmaco unico, & # 8221; ha detto il ministero.
In termini di tendenze di efficacia, ha affermato il ministero, i pazienti trattati con 2-DG hanno mostrato una cura sintomatica più rapida rispetto allo standard di cura (SoC) su vari endpoint.
& # 8220; Una tendenza significativamente favorevole (2,5 giorni differenza) è stata osservata in termini di tempo mediano per raggiungere la normalizzazione di parametri di segni vitali specifici rispetto a SoC, & # 8221; diceva.
& # 8220; I risultati degli studi clinici del farmaco hanno dimostrato che aiuta a un recupero più rapido dei pazienti ospedalizzati e riduce la dipendenza dall'ossigeno supplementare. Una percentuale maggiore di pazienti trattati con 2-DG ha mostrato una conversione RT-PCR negativa nei pazienti COVID, & # 8221; ha aggiunto.
Il ministero ha detto che il farmaco sarà di immenso beneficio per le persone che soffrono di COVID-19.
Ha detto che il DRDO ha iniziato a lavorare al progetto seguendo il primo ministro Narendra Modi & # 8217; la richiesta di preparazione contro la pandemia all'inizio dello scorso anno.
& # 8220; Nell'aprile 2020, durante la prima ondata della pandemia, gli scienziati INMAS-DRDO hanno condotto esperimenti di laboratorio con l'aiuto del Center for Cellular and Molecular Biology, Hyderabad e hanno scoperto che questa molecola funziona efficacemente contro il virus SARS-CoV-2 inibisce la crescita virale, & # 8221; ha affermato il ministero.
Sulla base di questi risultati, la CDSCO (Central Drugs Standard Control Organization) della DCGI ha autorizzato la sperimentazione clinica di fase II di 2-DG in pazienti COVID-19 nel maggio 2020.
Il ministero ha affermato che il DRDO, insieme a DRL, ha avviato gli studi clinici per testare la sicurezza e l'efficacia del farmaco nei pazienti COVID-19.
& # 8220; Negli studi di fase II condotti da maggio a ottobre 2020 , il farmaco è risultato sicuro nei pazienti con COVID-19 e ha mostrato un miglioramento significativo nel loro recupero, & # 8221; diceva.
& # 8220; La fase IIa è stata condotta in sei ospedali e la sperimentazione clinica di fase IIb (dose che varia) è stata condotta in 11 ospedali in tutto il paese. Lo studio di fase II è stato condotto su 110 pazienti, & # 8221; diceva.
Il ministero ha affermato che sulla base dei risultati positivi, DCGI ha ulteriormente consentito la sperimentazione clinica di fase III a novembre 2020.
Ha affermato che la sperimentazione clinica di fase III è stata condotta su 220 pazienti tra dicembre 2020 e marzo 2021 al 27 COVID ospedali a Delhi, Uttar Pradesh, Bengala occidentale, Gujarat, Rajasthan, Maharashtra, Andhra Pradesh, Telangana, Karnataka e Tamil Nadu.
& # 8220; I dati dettagliati della sperimentazione clinica di fase III sono stati presentati al DCGI. Nel braccio 2-DG, una percentuale significativamente più alta di pazienti è migliorata sintomaticamente e si è liberata dalla dipendenza dall'ossigeno supplementare (42% contro 31%) entro il giorno 3 rispetto al SoC, indicando un sollievo precoce dall'ossigenoterapia/dipendenza, & # 8221; ha affermato il ministero.
& # 8220; La tendenza simile è stata osservata nei pazienti di età superiore ai 65 anni, & # 8221; diceva.
-
- Il sito web di Indian Express è stato valutato VERDE per la sua credibilità e affidabilità da Newsguard, un servizio globale che valuta le fonti di notizie per i loro standard giornalistici.
-

