Forscher in Kalifornien züchten genetisch veränderte Mücken, die gegen den Malariaerreger immun sind. In der Freiheit könnten sie sich so vermehren, dass immer mehr immune Populationen entstehen, hoffen die Forscher.

Die Moskitos, die in Zukunft vielleicht einmal Millionen Menschenleben retten werden, leben in einem Keller in Südkalifornien, den nur eine Handvoll Personen betreten darf. Hinter zwei schweren Stahltüren, von denen sich jeweils nur eine öffnen lässt, wenn die andere geschlossen ist, schwirren sie in Popcorn-Bechern herum und saugen Blut von Kühen in sich auf.
Die Redaktion empfiehlt
Mückenplage in Tansania – ein Wettlauf gegen den Tod
In Afrika stirbt alle zwei Minuten ein Kind an Malaria. Es herrscht Krieg zwischen Mücken und Menschen. Um ihn zu gewinnen, arbeiten Wissenschaftler an neuen Strategien. Ein Besuch in Moskito City. (09.02.2017)
Welt-Malaria-Tag: “Wir dürfen die Hände nicht in den Schoß legen”
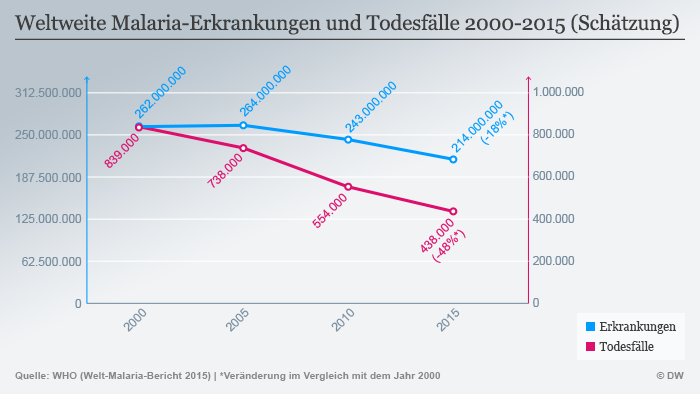
Zum Welt-Malaria-Tag fordert die Weltgesundheitsorganisation weitere Anstrengungen im Kampf gegen die Krankheit. Jährlich sterben daran 400.000 Menschen – vor allem in Afrika. Die DW sprach mit WHO-Experte Pedro Alonso. (25.04.2017)
WHO testet neuen Malaria-Impfstoff in Afrika
Alle zwei Minuten stirbt weltweit ein Kind an Malaria. Afrika ist von der Infektionskrankheit am schlimmsten betroffen. In Ghana, Kenia und Malawi plant die WHO deshalb ein Pilotprojekt. (24.04.2017)
Impfung: Mit Gentechnik gegen Malaria
US-Forscher haben einen neuen Malaria-Impfstoff entwickelt und in einer ersten Phase erfolgreich an Menschen getestet. Die Lebenderreger könnten sogar noch wirksamer sein als der Hoffnungs-Impfstoff RTS,S. (05.01.2017)
Mückenbekämpfung mit künstlichem Körpergeruch
Stechmücken sind nicht nur nervig. Jährlich sterben weltweit über eine Million Menschen an Krankheiten, die von Mücken übertragen werden. Nun haben Wissenschaftler eine neue Waffe gegen die Blutsauger erfunden. (11.08.2016)
Das bessere Moskitonetz
Mit Insektizid imprägnierte Bettnetze gelten als einzig wirksamer Schutz gegen Malaria. Das Problem: Beim Waschen geht das Gift verloren. Nicht so beim Life-Net, beim dem das Insektizid in der Kunststoff-Faser steckt. (19.04.2013)
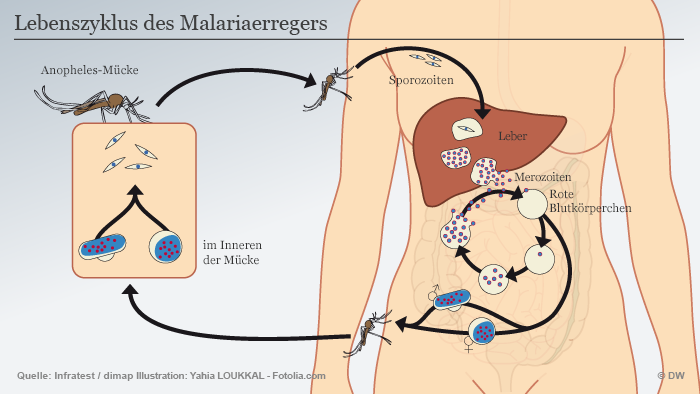
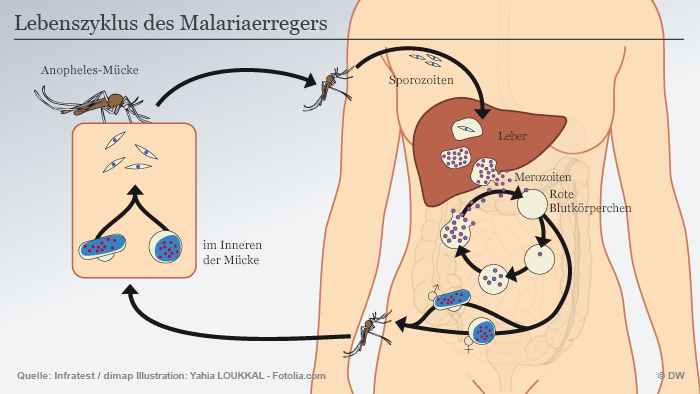
Es sind Mücken der Gattung Anopheles stephensi. In Indien gelten sie als wichtigster Überträger von Malaria. Die Insekten im US-Exil sind dazu allerdings nicht fähig. Denn die Arbeitsgruppe von Anthony James an der University of California in Irvine hat ihnen zwei Gene eingesetzt, die den Malaria-Erreger ausschalten.
Doch das ist noch nicht alles: Würden die Insekten aus den Popcornbechern sich mit wilden Anopheles stephensi paaren, könnten auch die Mücken der folgenden Generation keine Menschen mehr mit Malaria anstecken. Ebenso wenig deren Nachkommen und die Nachkommen der Nachkommen.
Lange, mühevolle Forschungsarbeit
Fast seine gesamte Karriere hat der 65-jährige James auf dieses Ziel hingearbeitet. Er kennt die Genetik der Mücken in- und auswendig, er hat die Konstrukte in ihrem Erbgut erfunden, die verhindern, dass die Insekten den Malaria-Parasiten weitergeben. Doch der letzte und entscheidende Schritt – dass sich diese Eigenschaft in einer Population verbreitet – daran haben seine Mitarbeiter und er sich die Zähne ausgebissen.
Alles was sie ausprobierten, funktionierte nicht so wie gewünscht. Doch jetzt ist James’ Moment gekommen: Im vergangenen Jahr wurde ein einfacher wie effektiver Trick erfunden, der die Gen-Mücken zu einer neuen Alternative der Krankheitsbekämpfung machen kann.
Diese Technologie heißt Gene Drive. Sie verleiht einem Gen Superkräfte bei der Vererbung. Während sonst bei sexueller Fortpflanzung stets ein Gemisch von väterlichen und mütterlichen Erbanlagen entsteht, setzt sich beim Gene Drive immer das manipulierte Merkmal durch.
Ein Gen ist stärker als die anderen
Im Fall von Anthony James’ Mücken heißt das: Ein paar Gene-Drive-Insekten könnten theoretisch innerhalb weniger Generationen ein ganzes Moskito-Volk immun gegen den Malaria-Erreger machen. Ohne weiteres menschliches Zutun. Auch für Tigermücken, die Dengue, Gelbfieber oder Zika übertragen können, sind Gene Drives in Entwicklung. Ließen sich also globale Gesundheitsprobleme durch die Freisetzung von ein paar Gene-Drive-Mücken lösen?
Video ansehen 01:37 Teilen
WHO warnt: Malaria bleibt große Bedrohung
Versenden Facebook Twitter google+ Tumblr VZ Mr. Wong Xing Webnews Yigg Newsvine Digg
Permalink http://p.dw.com/p/2UD1f
WHO warnt: Malaria bleibt große Bedrohung
Die Idee ist auch deshalb so verführerisch, weil der Erfolg aller anderen Maßnahmen gegen Mücken davon abhängt, dass Menschen sie anwenden. Dass sie Insektizide versprühen, stehendes Wasser beseitigen, in dem die Mücken brüten können, zum Schlafen unter imprägnierte Netze kriechen, und zwar regelmäßig, täglich, für immer. Genau deshalb sind auch schon so viele Versuche gescheitert. Entweder die Menschen lassen die Bekämpfung schleifen, oder die Mücken gewöhnen sich an die eingesetzten Chemikalien – sie sind bereits heute gegen zahlreiche Insektengifte resistent.
Effizienter als der Einsatz sterilisierter Moskitos
Die neue Methode wäre viel effizienter und billiger als der Einsatz von Insektiziden. Und auch die Nutzung “normaler” durch Genmanipulation sterilisierter Moskito-Männchen wäre nicht so nachhaltig. Diese Technik setzt darauf, dass sterile Männchen sich mit Mückenweibchen paaren, die dann keinen Nachwuchs mehr zeugen. Doch von den Männchen müssten immer wieder riesige Mengen ausgesetzt werden, um eine Wirkung zu erzielen.
Die Stiftung von Microsoft-Gründer Bill Gates und seiner Frau Melinda hat ihre Förderung für die Gene-Drive-Forschung im September von 40 auf 75 Millionen US-Dollar aufgestockt. Gates glaubt, die Technologie könne bereits in zwei Jahren eingesetzt werden. “Die Möglichkeit liegt direkt vor uns, wir müssen nur zugreifen”, sagt der Genetiker Francis Collins, Direktor der amerikanischen Gesundheitsbehörde NIH.
Das Erbgut selbst bedient die Genschere
Aber sollen wir wirklich zugreifen? Insekten, die frei in der Umwelt fremde Gene verbreiten, sind eine andere Kategorie als genmanipulierte Mäuse, die nie ein Labor von außen sehen. Gene Drive ist ein Spiel mit der Evolution.
Was, wenn sich das DNA-Konstrukt unbeabsichtigt auf andere Arten überträgt? Oder wenn zufällige Mutationen sich per Turbo-Vererbung verbreiten, die Malaria noch gefährlicher machen? Wer soll über den Einsatz von Lebewesen entscheiden, die an Landesgrenzen nicht Halt machen? Kritiker wittern eine Büchse der Pandora: Einmal in der Welt, lassen sich die Übel nicht zurückholen.

Gene Drive wurde durch die 2012 entdeckte Molekular-Schere Crispr/Cas9 möglich. Damit lassen sich Veränderungen am Erbgutmolekül DNA in einer Präzision vornehmen, die vorher nicht oder nur mit hohem Aufwand zu erreichen waren.
Beim Gene Drive bleibt es aber nicht beim Entfernen oder Hinzufügen einzelner Gene. Wissenschaftler bauen das Crispr/Cas9-Werkzeug gleich mit in das Erbgut ein. Dort spürt das System fortan wie ein Jagdhund jede ursprüngliche Version des veränderten Gens auf. Zum Beispiel, wenn bei der Paarung eine unerwünschte Genvariante dazukommt. Cas9 entfernt diesen DNA-Schnipsel, und die Zellen bauen stattdessen eine Kopie des manipulierten Gens ein. So entstehen bei der Fortpflanzung im Idealfall ausschließlich Zellen mit den erwünschten Genvarianten.
Video ansehen 03:45 Teilen
Mit Vorsorge gegen Malaria
Versenden Facebook Twitter google+ Tumblr VZ Mr. Wong Xing Webnews Yigg Newsvine Digg
Permalink http://p.dw.com/p/2brmM
Mit Vorsorge gegen Malaria
Unerwünschte Effekte nicht auszuschließen
In Anthony James’ Labor hat diese Turbo-Vererbung bei den Malaria-Mücken gut geklappt. Ein Test, ob die beiden eingebauten Gene wirklich die Verbreitung des Malaria-Erregers stoppen, steht noch aus. In früheren Experimenten ohne Gene Drive hat dies jedoch funktioniert.
Aber die meisten Fragen, wie sich Gene-Drive-Mücken auswirken, sind ungeklärt. Crispr/Cas9 ist zwar im Vergleich zu früheren Techniken ein präziseres DNA-Werkzeug. Doch schneidet die Molekül-Schere auch mal an Stellen, wo das nicht beabsichtigt war. Diese sogenannten Off-Target-Effekte könnten überhaupt keine Folgen haben. Sie könnten aber auch bewirken, dass etwas völlig Unvorhersehbares mit einer betroffenen Mücke passiert.
Und schließlich sind Moskitos auch enorm anpassungsfähig, sie haben gegen so gut wie alle Insektizide Resistenzen entwickelt. Warum sollten Mücke oder Erreger nicht auch gegen die Gene-Drive-Behandlung unempfindlich werden? Bestehende Gesetze zur Freisetzung von gentechnisch manipulierten Organismen decken die Möglichkeiten der Methode überhaupt nicht ab. Selbst wenn es doppelt oder dreimal so lange dauert, wie von Gates avisiert, Gene-Drive-Mücken einsatzbereit zu machen, ist das womöglich immer noch zu schnell, um alle Risiken zu identifizieren.
Forschung nur dort, wo die Tiere nicht heimisch sind
Trotz Doppel-Stahltür leben wegen der mit der Technologie verbundenen Risiken in Anthony James’ Kellerlabor keine Tigermücken mehr, die Überträger von Dengue und Zika. James hat die Insekten verbannt, denn Tigermücken sind auch in Kalifornien heimisch. Falls also ein Insekt entkommen wäre, hätte es theoretisch überleben und sich fortpflanzen können. “Es ist besser, wenn woanders an Gene Drives bei Tigermücken gearbeitet wird”, sagt James. “In Großbritannien besteht dieses Risiko zum Beispiel nicht.”
Trotz der schwer abzuschätzenden Risiken plädieren einige Forscher bereits für noch radikalere Lösungen. Sie möchten die wichtigsten krankheitsübertragenden Mückenarten gleich komplett ausrotten. Am Londoner Imperial College wurden Anopheles-Mücken so verändert, dass Weibchen durch den Gene Drive steril werden. Die Wissenschaftler argumentieren, dies sei sicherer, als nur das Virus auszuschalten. Schließlich könne die Malaria-Resistenz durch Mutationen wieder verloren gehen.
Anthony James überzeugt das nicht: “Ich halte es für sehr unwahrscheinlich, dass man wirklich alle Malaria-Mücken in einer Region mit einem Kill-Mechanismus erwischen kann. Irgendwo werden immer welche unentdeckt übrig bleiben und sich dann umso stärker vermehren.” Außerdem würde bei seiner Gene-Drive-Variante, die nur den Krankheitserreger stoppt, keine Art aus dem Ökosystem entfernt, wo sie womöglich eine wichtige Rolle spielt.
Computermodelle, die solche ökologischen Effekte abbilden, müssten aber noch erheblich weiterentwickelt werden, bevor sie überhaupt für eine Risikoabschätzung geeignet seien, bemängeln die National Academies of Science, ein Beratergremium der US-Regierung.
“Wir kennen diese Mücken und ihr gesamtes Erbgut wirklich ganz genau, wir können einen Gene Drive so konstruieren, dass das Risiko minimiert wird”, sagt Anthony James. Mücken bewegen sich zudem meist nur in einem Radius von rund 100 Metern. Ein in einem afrikanischen Dorf freigelassenes Insekt würde sich also nicht blitzschnell über die Welt verbreiten – wenn überhaupt, würde das sehr lange dauern. Viele der Ängste hält James deshalb für übertrieben.
Notbremse falls es schief geht
Wenn Wissenschaftler den Gene Drive beispielsweise auf Gene ausrichten, die nur in Mücken vorkommen, bliebe eine Übertragung auf andere Organismen folgenlos. Auch die Machart des Gene Drive selbst hat sich seit den ersten Veröffentlichungen bereits weiterentwickelt. Der Turbo-Vererbungsmechanismus kann beispielsweise durch einen weiteren Gene-Drive überschrieben werden – eine Art Notbremse für den Gen-Turbo.
Ein anderes Verfahren, das “Daisy Drive” getauft wurde, schaltet den Gene-Drive-Mechanismus nach einer Zeit von selbst ab. Der Biochemiker Kevin Esvelt vom Massachusetts Institute of Technology (MIT) sagt aber auch: “Es ist unmöglich, jedes erdenkliche Risiko dieser Technologie zu antizipieren.”
Unter dem Strich bleibt die Frage, ob es ethisch verboten oder geboten ist, die Technik zu nutzen – angesichts von Hunderttausenden Malariatoten pro Jahr? “Nichtstun resultiert auf jeden Fall in Leiden und Tod”, gibt Anthony James zu bedenken. Daraus eine moralische Verpflichtung abzuleiten, die Methode einzusetzen, geht ihm aber zu weit. Einige seiner Kollegen tun das, sagt der Amerikaner.
Die Bill & Melinda-Gates-Stiftung hält die Gene-Drive-Technologie bereits jetzt für unverzichtbar, um Malaria auszurotten. Im Oktober versprach auch der indische Milliardär Ratan Tata Forschern der University of California in San Diego 70 Millionen US-Dollar, um die Technologie zu erforschen und indische Biologen darin auszubilden.
Doch so groß der Optimismus auch ist, die Technologie steckt noch im Anfangsstadium. Und die Natur bleibt unberechenbar, wie auch Anthony James bei einem Feldversuch mit genmanipulierten Mücken in Mexiko feststellen musste. Seine damals noch ohne Vererbungs-Turbo genveränderten Mücken-Männchen sollten sterile weibliche Nachkommen zeugen. Im Labor hatte das wunderbar funktioniert und Moskitovölker nach einigen Wochen zuverlässig ausgelöscht. Allein, in den großen Freiluftkäfigen, bei realen Wetterbedingungen, wollten sich die Weibchen einfach nicht mit den Gentech-Männchen paaren.